Նախագծի անվանումը`»Մետաղներ»
Բովանդակությունը.Մետաղների
1).ընդհանուր բնութագիրը
Մետաղները պարզ նյութեր են, ունեն բնորոշ փայլ, անթափանց են, կռելի և ջերմության ու էլեկտրականության լավ հաղորդիչներ, անդրադարձնում են էլեկտրամագնիսական ճառագայթները: Այս առանձնահատկությունները պայմանավորված են մետաղների ատոմների կառուցվածքով և մետաղների բյուրեղներում ատոմների միջև մետաղական կապի գոյությամբ:
2).բնության մեջ տարածվածությունը
Մետաղների մեծ մասը հանդիպում է բնության մեջ միացությունների և հանքաքարերի ձևով։ Նրանք կազմում են օքսիդներ, սուլֆիդներ, կարբոնատներ և այլ քիմիական միացություններ։
3).ֆիզիկական հատկությունները
ֆիզիկական հատկությունները՝ գույնը, կարծրությունը, հալման ջերմաստիճանը, խտությունը, էլեկտրահաղորդականությունը և ջերմահաղորդականությունը, մետաղական փայլն ու անթափանցիկությունը, պլաստիկությունը:
4).քիմիական հատկությունները
Մետաղների ակտիվության շարքում մինչև ջրածինը տեղադրված մետաղները թթուների լուծույթից ջրածին են դուրս մղում, իսկ աջ տեղադրվածները ջրածին դուրս չեն մղում:
Յուրաքանչյուր մետաղ աղերի լուծույթներից դուրս է մղում այլ մետաղներ, որոնք լարվածության շարքում իրենից հետո են տեղադրված, իսկ ինքը դուրս է մղվում իրենից առաջ տեղադրվածներից:
- Թթվածնի հետ փոխազդում են բոլոր մետաղները, բացի ոսկուց և պլատինից: Արծաթի հետ փոխազդեցությունը նկատվում է միայն բարձր ջերմաստիճանների դեպքում, սակայն արծաթի (II) օքսիդը գրեթե չի առաջանում, քանի որ այն ջերմապես անկայուն է։ Կախված մետաղի տեսակից՝ ելանյութը կարող է լինել օքսիդ, պերօքսիդ:
{\displaystyle \mathrm {4Li+O_{2}=2Li_{2}O} } լիթիումի օքսիդ
{\displaystyle \mathrm {2Na+O_{2}=Na_{2}O_{2}} } նատրիումի պերօքսիդ
{\displaystyle \mathrm {K+O_{2}=KO_{2}} } կալիումի գերրօքսիդ
Պերօքսիդից օքսիդ ստանալու համար պերօքսիդը վերականգնվում է մետաղի միջոցով.
{\displaystyle \mathrm {Na_{2}O_{2}+2Na=2Na_{2}O} }
Միջին և ցածր ակտիվության մետաղների հետ ռեակցիան անցնում է տաքացման միջոցով.
{\displaystyle \mathrm {3Fe+2O_{2}=Fe_{3}O_{4}} }
{\displaystyle \mathrm {2Hg+O_{2}=2HgO} }
{\displaystyle \mathrm {2Cu+O_{2}=2CuO} }
- Ազոտի հետ փոխազդում են միայն ամենաակտիվ մետաղները, սենյակային ջերմաստիճանում փոխազդում է միայն լիթիումը՝ կազմելով նիտրիդներ:
{\displaystyle \mathrm {6Li+N_{2}=2Li_{3}N} }
Տաքացման ժամանակ՝
{\displaystyle \mathrm {2Al+N_{2}=2AlN} }
{\displaystyle \mathrm {3Ca+N_{2}=Ca_{3}N_{2}} }
- Ծծմբի հետ փոխազդում են բոլոր մետաղները՝ բացի ոսկուց ու պլատինից.
Երկաթը փոխազդում է ծծմբի հետ տաքացման դեպքում, կազմելով սուլֆիդ:
{\displaystyle \mathrm {Fe+S=FeS} }
- Ջրածնի հետ փոխազդում են միայն ամենաակտիվ մետաղները, այսինքն IA և IIA խմերի տարրերը, բացառությամբ բերիլիումի: Ռեակցիաները իրականացվում են տաքացման դեպքում՝ կազմելով հիդրիդներ: Ռեակցիաներում մետաղը հանդիսանում է վերականգնող, ջրածնի օքսիդացման աստիճանը -1 է։
{\displaystyle \mathrm {2Na+H_{2}=2NaH} }
{\displaystyle \mathrm {Mg+H_{2}=MgH_{2}} }
- Ածխածնի հետ փոխազդում են միայն ամենաակտիվ մետաղները, ընդ որում՝ ռեակցիայի ընթացքում ստացվում են ացետիլենիդներ կամ մեթանիդներ: Ացետիլենիդները ջրի հետ փոխազդելիս տալիս են աթետիլեն, մեթանիդները՝ մեթան:
{\displaystyle \mathrm {2Na+2C=Na_{2}C_{2}} }
{\displaystyle \mathrm {Na_{2}C_{2}+2H_{2}O=2NaOH+C_{2}H_{2}} }
5).ստացման եղանակները
Մաքուր մետաղների ստացման և հետագա օգտագործման համար անհրաժեշտ է դրանք զատել հանքաքարից և զտել։ Անհրաժեշտության դեպքում կատարվում է մետաղների լեգիրացում և/կամ այլ մշակում։ Դրա ուսումնասիրությամբ զբաղվում է մետալուրգիա կոչվող գիտությունը: Այն տարբերում է սև (երկաթի հիմքով) և գունավոր (դրանց բաղադրության մեջ չի մտնում երկաթը, շուրջ 70 տարր) մետաղների համաձուլվածքները։ Ոսկին, արծաթը և պլատինը դասվում են թանկարժեք (ազնիվ) մետաղների շարքին։ Բացի այդ, փոքր քանակությամբ մետաղներ առկա են նաև ծովի ջրում, բույսերում, կենդանի օրգանիզմներում, որոնք կարևոր նշանակություն ունեն օրգանական աշխարհի ձևավորման և գոյատևման գործընթացներում։
6).կիրառման բնագավառները։
Մետաղներից պատրաստում են կենցաղային զանազան իրեր, իսկ թանկարժեք մետաղներից՝ նաև զարդեր: Մետաղները նաև կիրառվում են շինարարության մեջ։
«Ընտանեկան դպրոցի հարցեր»
*֊Ո՞ր 7 մետաղներն են հայտնի եղել մարդկությանը դեռ հին դարերից…
Երկաթ, ոսկի, արծաթ, ալյումին, պղինձ, ցինկ և կապար
*֊ Ո՞ր առանձնահատկություն֊ ներն են բնորոշ բոլոր մետաղներին…
- Մետաղական փայլ
- լավ էլեկտրահաղորդականություն
- Հեշտ մեխանիկական մշակման հնարավորություն
- Բարձր խտություն
- Հալման բարձր ջերմաստիճան (բացառություններ են՝ սնդիկն ու ալկալիական մետաղները)
- Բարձր ջերմահաղորդականություն
- Ռեակցիաներում հիմնականում հանդիսանում են վերականգնողներ
*֊Ո՞ր մետաղն է ամենաշատը տարածված Երկրագնդում…
Երկրակեղևում ամենատարածված Մ․ են՝ Al (8,84%), Fe (4,65%), Mg (2,1%), Ti (0,63%)։
*֊Ո՞ր մետաղներն են կոչվում «ազնիվ».ինչու՞…
Ազնիվ մետաղները քիմիապես կայուն, դժվարահալ, կռելի, գեղեցիկ արտաքին տեսքով մետաղներ են: Ազնիվ մետաղներ են ոսկին, արծաթը, պլատինը և պլատինային մետաղները՝ իրիդիումը, օսմիումը, պալադիումը, ռոդիումը, ռութենիումը:
*֊ Ո՞ր մետաղն է ամենաշատը կիրառվում…
Ամենաշատը կիրառվում է ալյումինը։
Անհատական֊հետազոտական աշխատանքների թեմաները.
☆֊ Ի՞նչ դեր են կատարել մետաղները մարդկության զարգացման գործընթացում…
Մարդկության պատմության ընթացքում և ժամանակակից աշխարհում մետաղները շատ կարևոր դեր են խաղում: Մարդկային զարգացման տարբեր ժամանակաշրջանների պատմական բաժանումը նշանակվում է մետաղների և դրանց համաձուլվածքների անուններով ՝ պղինձ, բրոնզե երկաթ դարեր: Անցյալում և այսօր հնարավոր չէ պատկերացնել քաղաքակրթության գոյությունը՝ առանց տարբեր մետաղների օգտագործման: Եվ հնում և ժամանակակից հասարակության մեջ մետաղները, և մասնավորապես երկաթը, կազմել և հանդիսանում են մեր հասարակության հիմքը:
☆֊Ալկալիական մետաղներ`Na.K
Ալկալիական մետաղներ են IA խմբի մետաղները` լիթիում` Li, նատրիում` Na, կալիում` K, ռուբիդիում` Rb, ցեզիում` Cs: Ցանկացած ալկալիական մետաղի արտաքին էլեկտրոնային շերտ պարունակում է մեկ էլեկտրոն, որը համեմատաբար թույլ է կապված ատոմի միջուկի հետ: Ալկալիական մետաղները բնության մեջ հանդիպում են միայն միացությունների ձևով:
☆֊Հողալկալիական մետաղներ
Հողալկալիական մետաղաներ, պարբերական համակարգի II խմբի գլխավոր ենթախմբի քիմիական տարրեր՝ կալցիում (), ստրոնցիում (), բարիում () և ռադիում () (երբեմն Հողալկալիական մետաղաներին են վերագրում նաե և )։ Անվանումը կապված է այն բանի հետ, որ Հողալկալիական մետաղաների օքսիդները (ալքիմիկոսների տերմինաբանությամբ՝ «հողերը») ջրին հաղորդում են ալկալիական ռեակցիա։ Հողալկալիական մետաղաների ատոմների արտաքին էլեկտրոնային թաղանթը պարունակում է էլեկտրոն, որին նախորդում է և էլեկտրոնների թաղանթը։ Միացություններում ունեն օքսիդացման աստիճան։ Քիմիապես ակտիվ են, ակտիվությունը -ից աճում է։
☆֊Ալյումին`Al
☆֊Երկաթ` Fe

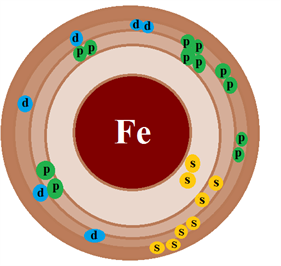
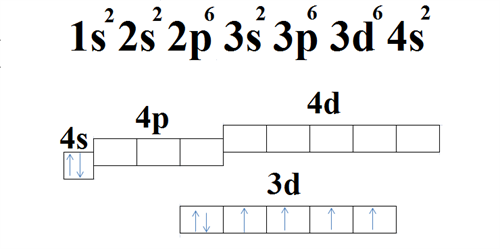
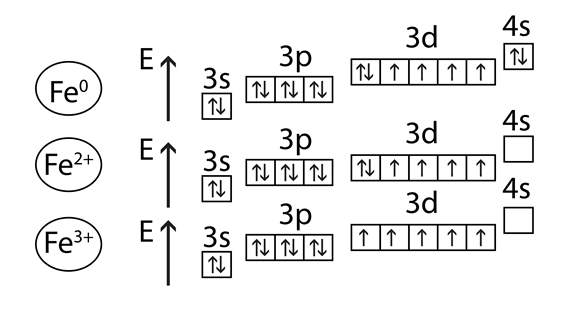


4Fe + 3Օ2 + 6H2Օ = 4Fe(OH)3
Ջրի հետ, բարձր ջերմաստիճանում.

























